Немного из истории фотокатализа
Катализ в переводе с греческого слова «каталюзис» означает разложение или разрушение. Этот термин встречается уже в XVI в. в сочинениях алхимика Либавиуса. Однако каталитические процессы использовались в практических целях ещё со времён глубокой древности, например приготовление теста при хлебопечении, сбраживание виноградного сока при получении вина, приготовлении уксуса и т. д.
Что касается фотокатализа, это слово состоит из двух частей: фото... (от греч. фотос — свет), соответствующей по значению слову «фотографический», и катализ — изменения скорости химических реакций в присутствии веществ (катализаторов), вступающих в промежуточное химическое взаимодействие с реагирующими веществами, но восстанавливающих после каждого цикла промежуточных взаимодействий свой химический состав. Таким образом, фотокатализ — это изменение скорости или возбуждение химических реакций под действием света в присутствии веществ (фотокатализаторов), которые поглощают кванты света и участвуют в химических превращениях участников реакции, многократно вступая с ними в промежуточные взаимодействия и регенерируя свой химический состав после каждого цикла таких взаимодействий [1].
Эффект фотокатализа — минерализации газообразных загрязнений на поверхности катализатора под действием мягкого ультрафиолетового излучения — открыт ещё в 20-е годы прошлого века. Однако наибольшему интересу к фотокатализу способствовали пионерские работы А. Фуджишима в 1970 году, которые открыли путь для широкого применения диоксида титана при конверсии солнечной энергии [2]. С этого момента разработано большое количество разнообразных фотокатализаторов.
Особенности фотокаталитических реакций и фотокатализаторов
Итак, фотокатализом называют изменение скорости химических реакций под действием веществ-катализаторов, активирующихся при облучении квантом света и участвующих в реакции, но не входящих в состав конечных продуктов.
В настоящее время разработано большое многообразие веществ-фотокатализаторов, ускоряющих различные реакции синтеза и разложения, протекающих при облучении светом.
В основном при фотокатализе фотокатализатор и реагирующие вещества находятся в разных фазах и отделены границей раздела, поэтому данный процесс можно отнести к гетерогенному катализу. Примером может служить использование диоксида титана в качестве фотокатализатора в многочисленных исследованиях.
Фотокаталитические реакции имеют характерные отличительные признаки. Прежде всего, фотокатализатор, изменяющий скорость реакции, является не пассивным, а активным участником химической реакции. Фотокатализатор может участвовать в промежуточных стадиях, и по окончании реакции он полностью регенерируется, то есть выходит из реакции таким же, каким вступил в реакцию. В идеальном случае фотокатализатор должен сохранять свои свойства очень долгое время. Однако во многих случаях состав фотокатализатора в той или иной степени изменяется. Часто фотокатализатор как бы отравляется самой реакцией, и активность его постепенно уменьшается. Примером может служить протекание фотокаталитической реакции на оксиде меди (I), способного к активности при облучении дневным светом, который восстанавливается до чистой меди в ходе реакции и, таким образом, уменьшается его активность.
Наличие фотокаталитических свойств различных материалов обусловлено особенностями их электронной структуры, а именно существованием в них валентной зоны и зоны проводимости. В основном в качестве фотоактивных материалов являются оксиды различных металлов, являющиеся полупроводниками.
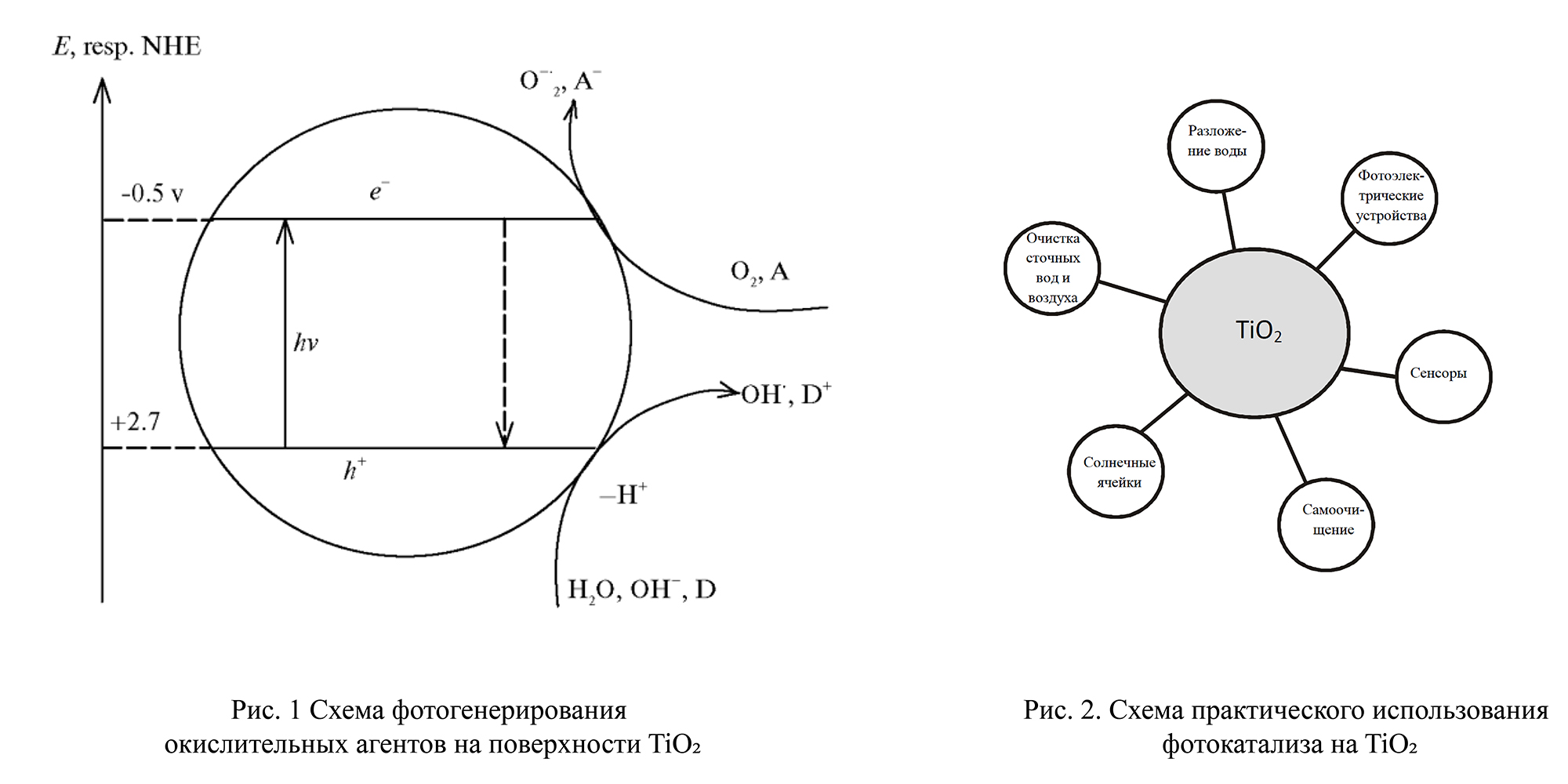
Для того чтобы в полупроводниках появилось достаточное количество электронов проводимости, необходимо перебросить электроны из заполненной зоны в зону проводимости. Для этого электроны должны получить дополнительную энергию и преодолеть так называемую ширину запрещённой зоны. Эту добавочную энергию кристаллы полупроводников получают за счёт энергии света. Тогда электрон в результате светового возбуждения переходит из заполненной электронной зоны в зону проводимости (рис. 1 Схема фотогенерирования окислительных агентов на поверхности TiO₂), например для TiO₂, и может участвовать в протекании фотокаталитической реакции. В электронной зоне вместо ушедшего электрона появляется, образно говоря, «пустое место», которое условно называют «дыркой», а более научное название которой — пазон. Дырки, в свою очередь, участвуют в фотокаталитическом процессе, и возникает как бы эстафетная передача электронов: какой-либо электрон занимает освободившееся место, его место занимает другой электрон и т. д.
Чем больше ширина запрещённой зоны, тем менее вероятен переброс электрона из валентной зоны в зону проводимости. Ширина запрещённой зоны (равная энергии активации электропроводности) зависит от природы твёрдого тела (полупроводник или изолятор) и может иметь различные значения — от десятых долей до 8–10 эВ (электронвольт).
Классификация фотокатализа
После краткой экскурсии в область электронных представлений о твёрдых телах возвратимся к классификации процессов фотокатализа. Согласно этой классификации основные фотокаталитические процессы можно условно разделить на два больших класса. При фотоиндуцированном катализе повышение скорости прохождения реакции обеспечивается катализатором, который образуется из ранее неактивного вещества (прекурсора) под воздействием света. При некоторых условиях подобные реакции могут идти и после прекращения облучения.
Фотоактивированный катализ схож с катализом фотоиндуцированным (в нём также из прекурсора образуется катализатор под воздействием света). Однако в процессе протекания основной реакции катализатор снова превращается в прекурсор. Поэтому для обеспечения катализа необходимо постоянное облучение.
Каталитические фотореакции как разновидность фотокатализа характерны тем, что катализатор в них играет традиционную роль. Под воздействием света же изменяются реагирующие вещества, переходя в так называемое возбуждённое состояние. В нём становится возможным их эффективное взаимодействие с катализатором. Соответственно, реакция идёт только под воздействием света.
Фотокаталитические реакции весьма распространены в природе. Наиболее ярким примером естественного фотокатализа является фотосинтез. В химической промышленности сегодня фотокатализ применяется весьма широко. С помощью него ускоряются различные реакции окисления, восстановления, полимеризации, гидрирования и дегидрирования, осаждения металлов. На основе эффекта фотокатализа производят системы очистки воды и воздуха [3].
TiO₂ как фотокатализатор
Диоксид титана — полупроводник. Согласно современным представлениям, в таких соединениях электроны могут находиться в двух состояниях: свободном и связанном. В первом состоянии электроны движутся по кристаллической решётке, во втором состоянии — основном — электроны связаны с каким-либо ионом кристаллической решётки и участвуют в образовании химической связи. Для перевода электрона из связанного состояния в свободное необходимо затратить энергию не менее 3,2 эВ. Эта энергия может быть доставлена квантами света с длиной волны менее 390 нм [4]. При поглощении кванта света в объёме частицы TiO₂ образуются свободный электрон (е⁻) и электронная вакансия — дырка (h⁺), которые рекомбинируют или мигрируют в полупроводнике, частично локализуясь на структурных дефектах его кристаллической решётки (рис. 1).
Фотокатализ на наночастицах
В последние годы размерные эффекты привлекают большое внимание исследователей, занимающихся проблемами фотокатализа, что связано с чрезвычайно высокой активностью наноразмерных частиц по сравнению с массивными материалами, обнаруженной в ряде случаев в реакциях, стимулированных светом.
Повышенная активность наноразмерных фотокатализаторов может быть объяснена высокой степенью дисперсности материалов, т. е. число атомов на поверхности или на гранях кристаллов сравнимо с числом атомов, расположенных внутри. Кроме того, при приближении размеров частиц полупроводниковых фотокатализаторов к нескольким нанометрам длина волны электрона становится сопоставимой с размером кристалла. В этом случае носители заряда рассматриваются на квантовомеханическом уровне как частицы в ящике, размеры которого определяются размерами кристалла. Наноразмерные частицы твёрдого вещества, в которых проявляются квантовые эффекты, называют Q-частицами [5].
Из-за пространственного ограничения, испытываемого фотогенерированными электронами и дырками в наночастицах полупроводников, носители заряда ведут себя как квантовые частицы в ящике. Проще говоря, чтобы удержаться в частице, они должны занимать уровень с более высокой кинетической энергией, чем в объёмных материалах. Электроны и дырки в таком состоянии всегда подвергаются кулоновскому притяжению.
Поэтому это состояние обычно называют экситонным, по аналогии с электростатически связанной парой электрон-дырка в объёме твёрдых тел. Для наноразмерных частиц различия между состояниями энергетических зон и экситонными уровнями не просматриваются. Возрастание кинетической энергии носителей заряда с уменьшением размера частиц оказывается больше кулоновского притяжения. В результате энергия экситонного перехода будет возрастать при снижении размера частиц.
Распределение энергетических уровней в наноразмерной частице полупроводника занимает некоторое промежуточное положение между массивным полупроводником и молекулой. Такое распределение приводит к тому, что наночастицы ведут себя практически как изоляторы. В этом случае весьма вероятно, что при поглощении света число генерированных основных носителей заряда значительно превысит число темновых. Накопление неравновесных носителей в частице ведёт к более сильному сдвигу квазиуровня Ферми основных носителей в наночастице при её освещении, чем в «массивном» полупроводнике.
Другое проявление квантовых эффектов в наноразмерных частицах полупроводников — это «голубой» сдвиг края собственного поглощения света, который является следствием увеличения ширины запрещённой зоны [5].
Практическое использование фотокатализа
На рис. 2 приведена схема практического использования фотокатализа с использованием диоксида титана в качестве фотокатализатора.
Осуществление фотокатализа позволяет окислять органические соединения в мягких условиях до CO₂ и H₂O. Кроме того, могут быть получены тонкие плёнки из TiO₂, нанесённые на стекло, что приводит к способности самоочищаться такого стекла под действием света от органических загрязнений за счёт процесса фотокаталитического окисления [4].
Литература:
1. Пармон В. Н. Фотокатализ: Вопросы терминологии // Фотокаталитическое преобразование солнечной энергии / Ред. К. И. Замараев, В. Н. Пармон. Новосибирск: Наука, 1991.
2. Fujishima A., Honda K. Electrochemical Photolysis of Water at a Semiconductor Electrode // Nature 238, 37–38; doi:10.1038/238037a0
http://www.nature.com/nature/journal/v238/n5358/abs/238037a0.html
3. Что такое фотокатализ? http://www.kakprosto.ru/kak-244805-chto-takoe-fotokataliz
4. Савинова Е. Н. Фотокаталитические методы очистки воды и воздуха. http://www.aerolifeshop.ru/clean_4.html
5. Артемьев Ю. М., Рябчук В. К. Введение в гетерогенный фотокатализ. — СПб.: Изд-во С.-Петерб. ун-та, 1999. — 304 с.
Автор статьи: Исаев А. Б. https://science.dgu.ru/Content/files/articles/Isaev%20A_B.pdf