На современном этапе развития науки фотокатализ определяют как «изменение скорости или возбуждение химических реакций под действием света в присутствии веществ (фотокатализаторов), которые поглощают кванты света и участвуют в химических превращениях участников реакции, многократно вступая с ними в промежуточные взаимодействия и регенерируя свой химический состав после каждого цикла таких взаимодействий» [1]. Рассмотрим это определение на примере реакции дегидрирования этилового спирта в водных растворах:
C2H5OH -> C2H4O + H2↑
При комнатной температуре эта реакция не идет. Она может идти под действием света с длиной волны меньше 205 нм, которая соответствует краю поглощения этанола. Но это жесткий ультрафиолет, который практически отсутствует в солнечном спектре, достигающем поверхности Земли. В присутствии же фотокатализаторов, например гетерополикислот 12-го ряда типа H3[PW12O40] или мелкодисперсного TiO2, эта реакция идет с высоким квантовым выходом под действием света, соответствующего спектру поглощения гетерополикислоты (λ <350 нм) или TiO2 (λ <400 нм). А света с такими длинами волн много в солнечном спектре. И таким образом, в данном случае фотокатализаторы возбуждают химическую реакцию или, как говорят, расширяют спектр действия системы, то есть область длин волн света, при облучении которым идет реакция.
Фотокатализ играет важнейшую роль в живой природе. Так, процесс фотосинтеза, обеспечивающий жизнь на Земле, фотокаталитический. В процессах очистки воды и воздуха от органических примесей в качестве фотокатализатора используют исключительно TiO2.
ПРИНЦИП ДЕЙСТВИЯ TiO2 КАК ФОТОКАТАЛИЗАТОРА
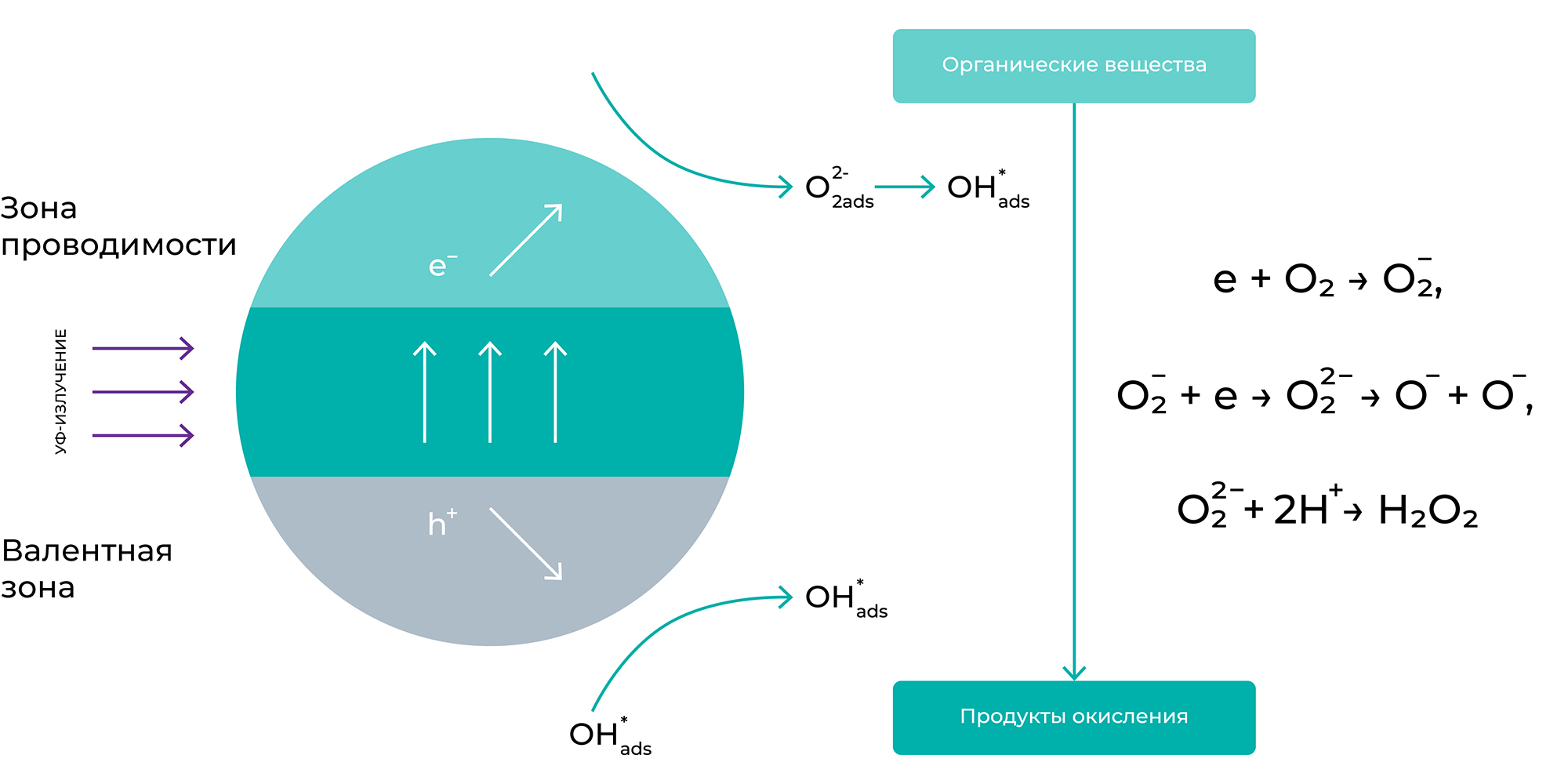
TiO2 — полупроводниковое соединение. Согласно современным представлениям, в таких соединениях электроны могут находиться в двух состояниях: свободном и связанном. В первом состоянии электроны движутся по кристаллической решетке, образованной катионами Ti4+ и анионами кислорода O2−. Во втором состоянии — основном электроны связаны с каким-либо ионом кристаллической решетки и участвуют в образовании химической связи. Для перевода электрона из связанного состояния в свободное необходимо затратить энергию не менее 3,2 эВ. Эта энергия может быть доставлена квантами света с длиной волны λ <390 нм. Таким образом, при поглощении света в объеме частицы TiO2 рождаются свободный электрон и электронная вакансия (в физике полупроводников такая электронная вакансия называется дыркой).
Электрон и дырка — достаточно подвижные образования, и, двигаясь в частице полупроводника, часть из них рекомбинирует, а часть выходит на поверхность и захватывается ею. Схематически процессы, происходящие на частице TiO2, изображены на рисунке.
Захваченные поверхностью электрон и дырка являются вполне конкретными химическими частицами. Например, электрон — это, вероятно, Ti3+ на поверхности, а дырка (электронная вакансия) локализуется на решетчатом поверхностном кислороде, образуя О−. Они чрезвычайно реакционноспособны. В терминах окислительно-восстановительных потенциалов реакционная способность электрона и дырки на поверхности TiO2 характеризуется следующими величинами: потенциал электрона ∼ −0,1 В, потенциал дырки ∼ +3 В относительно нормального водородного электрода. Иными словами, электрон способен реагировать с кислородом, рождая последовательность реакций:
Процессы, идущие на полупроводниковой частице (схематически):
O− + e -> O2−, H2O2 + e -> OH + OH−, O−+ H+ -> OH
При этом могут образовываться такие мощные окислители, как O− и OH⋅ -радикал. Вторым возможным маршрутом реакций электрона являются реакции:
e + H+ -> H (или e + H2O -> OH− + H⋅ ), H + H -> H2↑
Но второй маршрут реализуется только в водных растворах и при низких концентрациях кислорода. Основным же каналом исчезновения электрона являются реакции с кислородом.
Дырка реагирует либо с водой:
h + H2O -> OH + H+,
либо с любым адсорбированным органическим (в некоторых случаях и неорганическим) соединением:
h + CxHyOz -> CxHy–1Oz + H
OH⋅ -радикал или O также способны окислить любое органическое соединение. И таким образом, поверхность TiO2 под светом становится сильнейшим окислителем.
ЭФФЕКТИВНОСТЬ ДЕЙСТВИЯ ФОТОКАТАЛИЗАТОРА
Эффективность фотокатализатора определяется квантовым выходом реакции и спектром действия фотокатализатора. Квантовый выход фотореакции — отношение числа образующихся молекул продукта к числу поглощенных квантов света. Для полупроводниковых частиц как фотокатализаторов обычно рассматривают несколько стадий процесса:
а) поглощение света — рождение электрон-дырочных пар,
б) диффузия электронов и дырок к поверхности полупроводника,
в) объемная рекомбинация электронов и дырок,
г) поверхностная рекомбинация электронов и дырок,
д) полезные реакции электронов и дырок с адсорбированными молекулами.
Квантовый выход реакции Φ можно представить следующим образом:
Φ = ηiηr,
где ηi — доля носителей тока, достигших поверхности, ηr — доля носителей тока, достигших поверхности и вступивших в полезную реакцию (избежавших поверхностной рекомбинации).
Для вычисления ηi необходимо использовать уравнения, описывающие движения случайно блуждающих частиц. В самом общем случае упомянутые уравнения довольно сложны и не имеют решения в квадратурах. Однако в простых случаях, когда частицы можно считать сферическими, в их объеме отсутствуют электрические поля и скорости процессов рекомбинации и полезной реакции линейны по концентрациям электронов и дырок, решения получены. Несмотря на упрощения, эти решения дают ясное понимание основных закономерностей обсуждаемых процессов. В частности, если размер частицы становится сравним или меньше длины свободного пробега носителя тока (расстояние, которое успевает пройти электрон или дырка до рекомбинации), то ηi приближается к единице.
Из эксперимента известно, что для частиц TiO2 с радиусом r0 ∼ 25 Å все носители тока выходят на поверхность. Однако на практике не всегда самыми активными являются порошки TiO2 с мелкими частицами. Это можно объяснить анализируя фактор ηr:
ηr = Vr/(Vsr+Vr)
Здесь Vsr — скорость поверхностной рекомбинации, Vr – скорость полезной реакции. Фактор ηr может вносить определяющий вклад в Φ.
Обе скорости Vr и Vsr могут заметно изменяться в зависимости от структуры поверхности, то есть от строения и энергетики центров адсорбции и захвата носителей тока. В свою очередь, упомянутые свойства поверхности зависят от кристаллической структуры образца (для TiO2 наиболее распространены две кристаллические модификации — рутил и анатаз), метода синтеза, последующей процедуры обработки и т.д. или, как говорят, от предыстории образца.
К сожалению, к настоящему моменту нет надежных корреляций, связывающих активность с каким-либо свойством поверхности. Из практики известно, что наибольшей фотокаталитической активностью обладают образцы TiO2 с кристаллической модификацией анатаза и не содержащие большого числа примесей. И приготовление активного TiO2 — предмет опыта. Тем не менее практически все, кто занимается прикладным фотокатализом, обладают оригинальными методиками синтеза высокоактивного TiO2. А образцы серии Degussa P-25 и Hombikat UV-100 являются продуктами крупнотоннажного производства, высокоактивны как фотокатализаторы и недороги. Это дает возможность использовать фотокатализ на TiO2 в практике.
С научной точки зрения исследование природы фотокаталитического эффекта, механизма действия фотокатализаторов чрезвычайно интересно. В 1998 году ежемесячно выходило около 150 публикаций, посвященных фотокатализу. Помимо чисто прикладных работ растет число публикаций, в которых сообщается об исследовании фотокаталитических процессов различными физическими методами in situ. Наиболее плодотворны здесь методы ЭПР (электронного парамагнитного резонанса)- и ИК (инфракрасной)-спектроскопии, которые позволяют регистрировать промежуточные продукты превращения органических соединений на поверхности TiO2 и в некоторых случаях идентифицировать захваченные электрон и дырку. Однако до сих пор невозможно ответить на вопрос, почему близкие по свойствам (близкий размер частиц, одинаковая кристаллическая модификация) образцы TiO2 могут сильно различаться по фотокаталитической активности.
ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ TiO2 КАК ФОТОКАТАЛИЗАТОРА
Очистка воздуха от органических примесей
К настоящему моменту уже показано, что на поверхности TiO2 могут быть окислены (минерализованы) до СО2 и H2O практически любые органические соединения [2]. Если в состав соединений входят азот или атомы галогена Х, то в продуктах реакции будут наблюдаться HNO3 и HX. Единственным известным примером соединения, которое не подвергается на поверхности TiO2 окислению под действием света, является тетрахлорметан, но уже трихлорэтилен разрушается на TiO2 под действием света с квантовым выходом, превышающим единицу. Это связано с тем, что на поверхности TiO2 может образовываться атомарный Cl, который, десорбируясь с поверхности, стимулирует цепной процесс разложения исходного трихлорэтилена.
На практике любой фотокаталитический очиститель воздуха включает в себя пористый носитель с нанесенным TiO2, который облучается светом и через который продувается воздух. Органические молекулы из потока адсорбируются на поверхности фотокатализатора, нанесенного на пористое стекло (фотокаталитический фильтр), и окисляются до углекислого газа и воды под действием света от УФ-лампы. Эффективность действия такого устройства демонстрируется следующим опытом. Очиститель помещают в замкнутый объем (около 190 л), туда же добавляют ацетон. Наблюдение ведут по убыли ацетона и накоплению СО2.
Фактически фотокатализ дает уникальную возможность глубоко окислять органические соединения в мягких условиях, а простота самих устройств позволяет надеяться на прекрасные перспективы использования фотокатализа на практике. В настоящее время к широкому выпуску фотокаталитических очистителей воздуха приступили такие известные фирмы, как Toshiba, Sharp, TOTO. В России также готовится выпуск оригинальных фотокаталитических очистителей воздуха.
Помимо описанных устройств можно использовать активный TiO2 и для покрытия стен помещений. В этом случае вся поверхность помещения работает как очиститель воздуха. На поверхности TiO2 под действием света не только разрушаются органические молекулы, но и гибнут вредные микроорганизмы, даже обладающие высокой сопротивляемостью к ультрафиолету.
Самоочищающиеся стекла
TiO2 — соединение, прозрачное для видимого света, поэтому тонкие пленки из TiO2, нанесенные на стекло, незаметны для глаза. А само стекло, покрытое такой пленкой, способно самоочищаться под действием света от органических загрязнений за счет фотокаталитического процесса окисления.
Под действием естественного света или света от ламп дневного света за 1 ч на поверхности может разрушиться слой толщиной 60 Å таких органических соединений, как, например, жирные кислоты, выделяющиеся при жарке продуктов. Выпуск таких стекол будет налажен в ближайшее время.
Незапотевающие зеркала и стекла
Запотевание стекла связано с плохой смачиваемостью поверхности, то есть образованием на поверхности слоя мелких капелек воды, рассеивающих свет. Поверхность стекла или зеркала чаще всего плохо смачивается из-за загрязнения органическими веществами, которые попадают на них из воздуха или при касании, например руками. Тонкая прозрачная пленка фотоактивного TiO2 под действием света разрушает органические загрязнители, поверхность хорошо смачивается, и вода, попадающая на такую поверхность, не собирается в капельки, а растекается по поверхности, а затем испаряется. В группе автора этой статьи было приготовлено зеркало, ровно половина которого была покрыта пленкой TiO2. Глазом наличие такой пленки обнаружить невозможно. Было интересно наблюдать, как с одной половины зеркала запотевание исчезает в течение секунды, а на второй половине долго сохраняется, если подышать на это охлажденное зеркало. Вероятно, выпуск таких зеркал и стекол также будет освоен в ближайшем будущем.
Использование фотокатализа для очистки воды от органических примесей
Так же, как и в воздухе, в воде органические примеси, попав на поверхность частички TiO2, могут быть окислены до СO2 и Н2О. К настоящему времени показано, что в облучаемых суспензиях TiO2 этому процессу подвержены практически любые органические соединения. Однако, как правило, характерные времена полного окисления составляют несколько часов, это частично связано с существенно более медленной диффузией органических молекул в воде, чем в воздухе. Типичный коэффициент диффузии в воде составляет около 10−5 см2/с, что по крайней мере на четыре порядка меньше, чем в воздухе при нормальных условиях. По этой причине проточные реакторы с нанесенным TiO2 малоэффективны. Использование суспензии TiO2 технологически считается не совсем удобным, так как требует последующего удаления TiO2 из потока. В принципе эти проблемы решаются, однако до сих пор неизвестны примеры практического использования проточных фотокаталитических реакторов с гетерогенным катализатором из TiO2.
Наиболее перспективно использование TiO2 для очистки сточных вод в накопительных резервуарах и отстойниках. Показано, что пестициды, используемые в сельском хозяйстве, в водоемах разрушаются в течение нескольких месяцев. Добавление небольших количеств безвредного TiO2 позволяет сократить это время до нескольких дней без использования искусственных источников света, так как процесс идет под действием солнечного света.
Существующие проточные реакторы для очистки воды от органических примесей используют гомогенные фотокатализаторы типа солей железа, при этом в воду добавляется и окислитель — перекись водорода. В общих чертах механизм действия такой системы можно описать следующим образом:
Fe2+ + H2O2 -> Fe3+ + OH− + OH,
Fe2+ + OH -> Fe3+ + OH−,
OH + H2O2 -> HO2 + H2O,
HO2 + Fe3+ -> Fe2+ + H+ + O2,
OH˙ + органическое соединение продукты окисления.
Раствор перекиси водорода и соли железа называют реагентом Фентона. Как видно, в ходе процесса разложения перекиси водорода образуется OH˙-радикал, который является сильнейшим окислителем. Эта частица и ответственна за окисление органических соединений в растворе. Под действием света скорость процесса окисления может увеличиться в десятки и даже сотни раз; система носит название «Фото-Фентон». И хотя механизм действия света еще окончательно не понят, система уже нашла практическое применение из-за простоты, высокой эффективности и экономичности. В частности, технологическое оборудование для очистки сточных вод по методу «Фото-Фентон» поставляется фирмой Calgon Carbon Oxidation Technologies, USA.
ЗАКЛЮЧЕНИЕ
Фотокаталитические технологии очистки воды и воздуха находятся еще на пороге широкого практического использования. Несомненно, что они будут совершенствоваться, но и сейчас уже ясны достоинства, обусловливающие их привлекательность и перспективы. Это простота, экономичность, возможность использования солнечного света. Последнее крайне важно для будущего, когда энергосберегающие технологии, безусловно, будут иметь преимущество.
ЛИТЕРАТУРА
Пармон В.Н. Фотокатализ: Вопросы терминологии // Фотокаталитическое преобразование солнечной энергии / Ред. К.И. Замараев, В.Н. Пармон. Новосибирск: Наука, 1991. С. 7–17.
Photocatalytic Purification and Treatment of Water and Air / Ed.by D.F. Ollis, H. Al-Ekabi. Elsevier, 1993.
Рецензент статьи Г.В. Лисичкин
* * *
Евгений Николаевич Савинов, доктор химических наук, профессор кафедры физической химии Новосибирского государственного университета, зав. группой фотокатализа на полупроводниках Института катализа СО РАН.
Область научных интересов — фотокатализ на дисперсных полупроводниках, фотокаталитические технологии очистки воды и воздуха от органических примесей, фотофизика и фотохимия нанополупроводников, кинетика фотопроцессов в микрогетерогенных средах. Автор и соавтор более 90 научных публикаций, шести авторских свидетельств и патентов России.